|
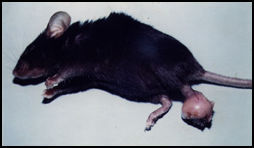
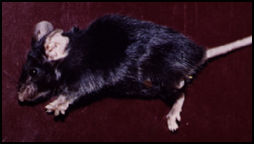
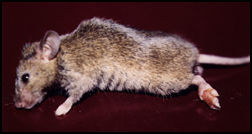
Em termos de modelos experimentais, após uma fase em que o hamster era o animal de escolha e com os estudos sobre a evolução das infecções por diferentes isolados, o camundongo tornou-se o modelo central. Isto se deve em grande parte aos estudos imunológicos que passaram a ser desenvolvidos em grande escala nos últimos 13 anos e ao avanço no conhecimento sobre as características genéticas do hospedeiro na evolução da infecção por diferentes espécies de leishmanias. Assim em várias linhagens de camundongo têm sido empregadas para avaliar a imunidade natural nas leishmanioses e muitos esforços têm sido feitos para explicar a natureza da resposta imune. Muitos parâmetros estão envolvidos, contudo, apresentando inúmeras variáveis que precisam ser bem definidas visando explicar seu papel na indução, expressão e regulação da proteção induzida após a infecção experimental. Estas variáveis, como por exemplo, dose, via, cepa de leishmania e estágio evolutivo do parasita, podem explicar os dados contraditórios que se observam na literatura com relação à resistência de cepas de camundongos isogênicos ao parasito (Bradley, 1987). Camundongos inoculados subcutâneamente com L. mexicana desenvolvem lesões locais, inicialmente nodulares não ulceradas. Posteriormente ocorrem grandes aumentos de volume e a lesão evolui para ulceração (Coutinho-Abath & Coelho, 1965). A visceralização do parasita (Nery-Guimarães, 1965), e a ocorrência de metástases nas patas, orelhas e caudas são frequentemente observadas em camundongos albinos inoculados com L. amazonensis subcutâneamente numa das patas (Calabrese & Gonçalves da Costa, 1992). Foi demonstrado também que a via intraperitoneal induz com mais frequência a formação de metástases (Nery-Gumarães, 1965). Outros fatores como a idade e o sexo dos camundongos podem também influenciar o curso da doença (Alexandre, 1988). Observações feitas por Bradley (1971, 1972 e 1974), mostraram o papel relevante das características genéticas do hospedeiro no curso da infecção por L. donovani . Perez e col. (1979a), foram os primeiros a descrever o curso variável da infecção por L. mexicana , com caracterização clínica em diferentes linhagens isogênicas de camundongos, mostrando que a L. mexicana quando inoculada em camundongos BALB/c, causa lesões que aumentam continuamente, ulceram e produzem metástases.
Outras linhagens de camundongos, C57Bl/6 e AKR respodem ao mesmo ensaio com lesões que crescem e ulceram rapidamente, mas regridem e curam dentro de 5 meses ou mesmo evoluem lentamente e regridem sem ulcerar. Camundongos DBA/2 e NMRJ entretanto, quando inoculados em iguais condições, desenvolvem lesões nodulares não ulcerosas cujo crescimento estabiliza-se após a décima quarta semana.
Ao se afirmar que camundongos C57BL são resistentes à L. mexicana ou L. amazonensis é importante precisar a linhagem de C57BL, visto que camundongos C57BL/10 são extremamente sensíveis a estas espécies (Calabrese & Gonçalves da Costa, 1992).
Por outro lado a linhagem DBA/2 aparece na literatura com resultados contraditórios tanto em relação à resistência contra L. major quanto à L. mexicana (Bradley, 1987). A resistência de algumas linhagens de camundongos parece ser relativa, sendo possível estabelecer diferenças de infecção em função da quantidade de inóculo e da via de inoculação. Camundongos C57BL/6 considerados resistentes a L. major por exemplo, passam a ser suscetíveis ao serem inoculados por via intravenosa (Scoth & Farel, 1982).
Camundongos CBA infectados com inóculo gradual de promastigotas de L. tropica , mostraram que a severidade da infecção é dependente da dose infectante (Preston & Dumonde, 1976). Julgamos, entretanto, que os dados contraditórios sobre a resistência de linhagens de camundongos singênicos se deve também a fatos que muitos autores desafiam os animais com parasitos na forma amastigotas, enquanto outros empregam formas promastigotas. Desta forma é importante que o assunto seja revisto em função de todas essas variáveis que discutimos acima e que se possa ter um modelo de estudo das leishmanioses em camundongos singênicos de forma padronizada. A resistência adquirida à L. donovani , no camundongo, está sob controle de genes localizados no complexo principal de histocompatibilidade H-2 (Blackwell e col., 1980; Blackwell, 1982). A resistência à L. major é controlada pelo gen autossômico (Blackell e col., 1934) localizado fora do Complexo Principal de Histocompatibilidade H-2. Existe a possibilidade de que outros genes participem no controle da leishmaniose cutânea por mecanismos ainda não conhecidos (Fortier e col., 1984). Camundongos que apresentam um comportamento polar em relação a infecção por L. mexicana , também exibem diferenças imunológicas importantes. Perez e col. (1978), mostraram que camundongos resistentes produzem anticorpos específicos anti-leishmania e desenvolvem reações de hipersensibilidade cutânea tardia. Já em camundongos suscetíveis tanto o desenvolvimento de hipersensibilidade tardia quanto a produção de anticorpos anti-leishmania foram prejudicados. Estudando a infecção de camundongos Balb/c e C57BL/6 pela L. amazonensis, Barral e col. (1983), mostraram que camundongos suscetíveis Balb/c, desenvolvem respostas positivas aos testes de hipersensibilidade tardia contra antígenos parasitários, mas esta reatividade desaparece posteriormente. Ao contrário, no camundongo C57Bl/6 os testes de hipersensibilidade permanecem positivos por longo tempo. No período de desenvolvimento da lesão metastática ulcerativa, os animais Balb/c ainda apresentam testes positivos em declínio. Andrade e col. (1984), também observaram respostas positivas transitórias na reação cutânea tardia a antígenos parasitários em camundongos Balb/c infectados com L. mexicana. O desenvolvimento da hiporesponsividade "in vivo" e "in vitro", que ocorre em camundongos Balb/c cronicamente infectados por L. mexicana, foi explicado pelo aparecimento de uma célula supressora (Arredondo e Perez, 1979). Nos animais resistentes, também ocorre uma imunosupressão não específica, porém transitória, com níveis máximos de 11 semana após a infecção, retornando gradualmente a níveis normais (Perez e col., 1981). É amplamente aceito que a resposta imune mediada por células, mais do que a humoral, tem papel fundamental no determinismo da forma clínica e na resistência adquirida às leishmanias (Mitchel e col., 1980), como ocorre aliás em todos os casos de parasitas de macrófagos (Mackaness, 1977). Duas populações principais de células T humanas foram descritas, havendo muitas evidências que as duas populações CD4+ e CD8+ podem contribuir para a proteção ou patogenia da infecção, apesar do papel das células T CD8+ ser menos entendido, possivelmente porque raros clones com estes fenótipos direcionados contra antígenos parasitários foram estabelecidos até o momento (Kaufman, 1988; Fong e Mosman, 1990; Louis e col., 1992). A produção de linhagens celulares e clones da subpopulação CD4+ têm aumentado nosso entendimento sobre o papel destas células nas respostas imunológicas à L. major (Scott e col., 1988; Scott, 1989). A interpretação de que células T com o mesmo fenótipo podem ser funcionalmente heterogêneas, foi demonstrado por alguns autores (Mosman e col., 1986; Locksley e col., 1987; Scott e col., 1988) que evideciaram a existência de subgrupos funcionalmente diferentes com fenótipo L3T4+ (CD4+), onde pelo menos duas subpopulações destas células foram identificadas de acordo com a produção de linfocinas. As subpopulações TH1, mediando a resposta imune celular. produzem IL2, IL3 e IFN-. O segundo grupo, Th2 secreta preferencialmente IL-4 e IL-3, sendo possível que estas interleucinas atuem a nível dos macrófagos, visto que a ativação destas células contendo amastigotas de leishmania, constituem o mecanismo que leva à destruição destes parasitas intracelulares. Embora a correlação entre a produção de interferon "in vivo" e a resolução das lesões induzidas por L. major seja também relatada por numerosos experimentos (Locksley e col., 1987; Heinzel e col., 1989), a questão da participacão do IFN- na resistência à leishmania permanece em discussão. Surgem na literatura indicações sobre o possível papel do fator de necrose tumoral (TNF) neste processo. O TNF é uma proteína produzida principalmente por macrófagos e a capacidade destas células de o produzirem parece estar correlacionada com a resolução das lesões nas leishmanioses cutâneas murinas (Titus e col., 1989; Liew, 1990; Green e col., 1990). No entanto, muitos resultados não implicam em que todas as células TH1 reativas à leishmania, sejam necessariamente protetoras. Um número crescente de trabalhos no modelo camundongo têm demonstrado que a heterogeneidade das células T CD4+ é maior do que a divisão entre TH1 e TH2 (Firestein e col., 1989). Apesar dos esforços realizados até o momento, não foi possível demonstrar a existência de subgrupos distintos de células (TH1 e TH2) em humanos, provavelmente por problemas metodológicos inerentes à pequisa em seres humanos.
|
©1997 FIOCRUZ |